本年度第24回日本蛋白質科学会年会(札幌)におけるポスター受賞者の方から原稿をいただきましたのでここにお知らせします(演題番号順)。
日本蛋白質科学会 役員会
1P-020 石川 潤一郎(東京大学)

この度は第24回日本蛋白質科学会年会にてポスター発表賞を頂き大変光栄に思います。審査員の先生方をはじめ、学会関係者の皆様に、この場をお借りして深く感謝申し上げます。
近年、メタゲノム解析により原核生物のもつファージに対する感染防御機構が次々と発見され、その多様な分子機構が明らかになってきました。これまでに、原核生物の感染防御機構から発見されたCRISPR-Cas酵素や制限酵素などは、現在の生命科学実験において必須の技術となっています。したがって、原核生物の感染防御機構には、人類にとって有益なタンパク質がまだ存在しているかもしれません。
私は原核生物のRetronに着目して研究を進めてきました。Retronは30年以上前に発見されたにも関わらず、その生理的機能は長らく不明でした。近年の研究から、ようやくRetronが原核生物の感染防御機構に関連することが明らかになりましたが、その詳細な分子機構は不明でした。私はクライオ電子顕微鏡を用いた構造解析、生化学実験、およびファージ実験により、大腸菌由来のRetronがどのようにファージの感染を認識して、ファージに対する感染防御を示すのかを明らかにしました。特にRetronのもつ独自の逆転写酵素によって合成される特殊なRNA–DNA複合体の役割を解明しました。今後は、Retronの逆転写酵素の詳細な分子機構を解明し、ゲノム編集ツールへの応用を目指して本研究を展開させたいと考えています。
最後に、本研究を進めるにあたりご指導いただいた西増教授をはじめ、西増研究室の皆様、そして共同研究者の方々に、この場を借りて心より感謝申し上げます。
1P-063 小山 拓豊(京都大学)

この度は第24回日本蛋白質科学会年会におきまして、ポスター賞をいただき、大変光栄に存じます。
化合物–タンパク質間相互作用(CPI)は、創薬において重要な役割を果たしています。CPIの実験的な検証には多大なコストと時間がかかるため、近年、計算手法による予測が注目されています。しかし、既存のCPI予測手法では、全く未知の化合物-タンパク質ペアを予測することが困難とされており、より汎化性能の高いCPI予測AIモデルの開発が求められています。
そこで、私たちは大規模言語モデルを活用したCPI予測モデルとして「ChemGLaM」を提案致しました。ChemGLaMは、化学言語モデルであるMoLFormerとタンパク質言語モデルであるESM-2という大規模に事前学習された言語モデルを活用し、両者の出力をクロスアテンション機構によって統合することでCPIの学習を行います。ChemGLaMは既存手法を上回る性能を示し、また学習によって獲得したクロスアテンションマップを用いることで、化合物-タンパク質の相互作用メカニズムに関する洞察を提供することができました。
今後は、さらにモデルのアーキテクチャや学習手法を改良し、モデルの汎用性を向上させることを目指します。最後に、ご指導を賜りました奥野恭史教授をはじめ、研究室の皆様、学会関係者の皆様にこの場をお借りして厚く御礼申し上げます。
1P-077 氏家 寛(東京大学)

この度は第24回日本蛋白質科学会年会にてポスター賞を賜り、大変光栄に存じます。学会関係者の皆様、そして津本浩平先生をはじめとしてご指導いただいております先生方、そして日々の研究生活を支えていただいている津本研究室の皆様に深く感謝申し上げます。
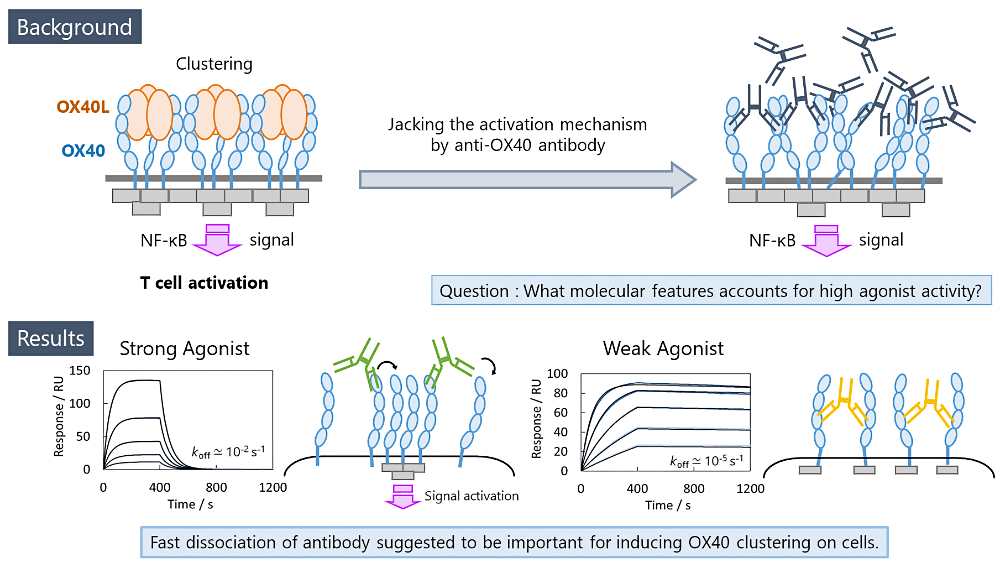
ポスター発表では、T細胞活性化を担う膜蛋白質OX40に対するアゴニスト抗体の設計指針について報告いたしました。OX40はT細胞表面でクラスター化することでNF-κBシグナルを活性化しT細胞の活性化を誘導することから、OX40をクラスター化させる抗OX40アゴニスト抗体はがん免疫療法などへの応用が期待されます。すでに複数の抗OX40抗体の抗腫瘍活性が認められ臨床試験段階にある一方で、先行研究により、抗体自体が持つNF-κBシグナル誘導活性がそれらの抗体間で全く異なることが示唆されていました。
本発表では、これらの抗体のOX40クラスター化能の違いが抗体とOX40の分子間結合の解離速度やエピトープ部位の違いによることを示しました。さらに抗体の解離速度が速く、OX40に対する結合と解離を速いサイクルで繰り返すこと、またOX40クラスターの立体障害にならない結合部位を持つことが、OX40を細胞表面でクラスター化させるために重要であることを示唆する結果を報告いたしました。
発表を聞いてくださった皆様との議論にもございました通り、今後は仮説を立証するための細胞表面でのOX40クラスターについての可視化やin silicoベースでのモデル系構築を目指して研究をより深化させてまいります。
1P-080 長尾 崇弘(東京大学)

この度は、第24 回日本蛋白質科学会年会にてポスター賞をいただき大変光栄に思っております。また、学会を運営してくださった方々、審査員の先生方をはじめとした学会関係者の皆様に感謝申し上げます。
小胞体とミトコンドリアは、膜間が10–30 nm程度まで非常に滑らかに近接した接触場を形成し、細胞の恒常性維持に重要な役割を果たしています。これまで、この接触場形成には、タンパク質複合体形成による繋留が必要であると示唆され、実際に様々な種類の複合体が報告されてきました。しかしながら、流動性のあるオルガネラ膜上でタンパク質複合体が密に集積して点状の接触場が形成される可能性もある中で、なぜ小胞体-ミトコンドリア接触場が広く滑らかに接触した形態をとるのかは未だ明らかになっていません。
本学会では、繋留とは違う側面からの新規メカニズムを発表させていただき、非常に実りある議論をする中で、研究を進める新たなアイデアとエネルギーをいただきました。この経験を糧に、今後も研究に一層邁進してまいります。
最後に、日頃からご指導いただいている平林祐介准教授をはじめ、研究室メンバーの方々、お世話になっているすべての皆様に厚く御礼申し上げます。
1P-128 倉持 円来(東北大学)

この度は第23回日本蛋白質科学会年会におきましてポスター賞を授与いただき、大変光栄に思います。審査員の先生方をはじめ、学会関係者の皆様に深く御礼申し上げます。
インスリンはプロインスリンとして小胞体内に挿入され、ジスルフィド結合形成を伴う立体構造形成である酸化的フォールディングを受け、成熟し、機能を発現します。Ⅱ型糖尿病モデルのAKITAマウスのインスリンは、酸化的フォールディングがうまく進行せず、非天然型のジスルフィド結合形成により小胞体ストレスや細胞死を惹起し、Ⅱ型糖尿病の原因となることが指摘されていますが、プロインスリンの酸化的フォールディングについての多くは未だ不明です。本研究では、プロインスリンの酸化的フォールディングにおける重要なフォールディング中間体の構造生物学的意義を追求しただけでなく、小胞体内局在酵素・シャペロンProtein Disulfide Isomerase(PDI)familyによる触媒メカニズムについて新しい知見を得ることができました。今後も研究に邁進し、論文として成果報告できるよう進めていきます。
最後になりましたが、日頃ご指導いただいております奥村正樹准教授をはじめ、共同研究者の先生方にも深く感謝いたします。
2P-022 南 未来(北海道大学)

この度は24回日本蛋白質科学会においてポスター賞を授与いただき、大変光栄に思っております。審査員の先生方をはじめ学会の運営関係者の皆様、ポスターまで足を運んでくださった皆様にこの場をお借りして心より御礼申し上げます。
狂犬病ウイルスが引き起こす狂犬病は有効な治療法が存在せず、発症後の致死率は100%です。狂犬病ウイルスのゲノムにコードにされているPタンパク質(RVP)は病原性決定因子の1つとして知られています。RVPはヒト転写因子であるSTAT1を不活化することで、ヒトの免疫経路から回避し、自身の増殖に有利な環境を作り出しています。しかし、詳細なRVPによるSTAT1阻害の分子機構は不明でした。そこで本研究ではRVPとSTAT1の相互作用基盤の解明を目指し、両者の相互作用領域の特定を目的とした相互作用解析の結果やクライオ電子顕微鏡単粒子解析による複合体構造について報告させて頂きました。この受賞を励みに、これからも研究に邁進していきたいと思います。
最後となりましたが、日頃からご指導をいただいて尾瀬農之先生、姚閔名誉教授先生、稲葉理美先生、構造生物化学研究室の皆様、共同研究先である杉田征彦先生に心より感謝申し上げます。
2P-031 野間井 智(北海道大学)

この度、第24回蛋白質科学会年会において栄誉あるポスター賞を賜り、大変光栄に感じると同時に身の引き締まる思いです。また、長年お世話になっている前仲勝実先生の手から賞状を頂けたことがとても感慨深いです。審査員の先生方はじめ、学会運営に当たった全ての方、また、前仲勝実先生、喜多俊介先生並びに日頃より指導いただいている先生方に改めて心よりお礼申し上げます。
今回は、SARS-CoV-2の昨年の流行株であるオミクロンEG.5.1のSタンパク質の構造解析について報告させていただきました。わずかな変異が流行に影響を与えたという事実が先にあり、構造生物学でその複雑な現象の一端を紐解くことができたと考えております。COVID-19に対する社会の関心は薄れつつありますが、次なる新興・再興感染症に備えて研究する意義は大きいはずです。会場では同じくSARSCoV-2研究に取り組む方も多く、非常に有益な議論をさせていただきました。私はいわゆるコロナ禍をCOVID-19患者受け入れ施設の病院薬剤師として過ごしていました。ワクチンの早期開発に貢献したクライオ電子顕微鏡の技術革新とスピード感に驚いていたものですが、いまや構造解析を行う側にまわっているのはとても不思議な感覚です。
本ポスターの内容を含む論文が、年会の数日後にアクセプトされました。進学し、基礎研究に戻ってから1年間取り組んできた内容が、わずか1週間で一斉に成果となっており、嬉しい反面少し戸惑っております。
最後になりますが、本研究のご指導並びに発表の機会をくださった京都大学 医生物学研究所 橋口 隆生先生、北海道大学 医学研究院 福原 崇介先生、東京大学 医科学研究所 佐藤佳先生に重ねて感謝申し上げます。
2P-090 吉川 一歩(北海道大学)

この度は第24回蛋白質科学会年会において、ポスター賞をいただけましたこと大変光栄に思っております。審査員の先生方、並びに学会関係者の皆さまに厚く御礼申し上げます。
私の研究対象であるジベレリン調節タンパク質(GRP)は、花粉や果実に存在しアレルギー症状を引き起こす抗原性のタンパク質ファミリーです。GRPはシステインに富むタンパク質であり、その遺伝子組換え発現の宿主に酵母の分泌系を利用しています。私は、酵母の小胞体に備わるタンパク質品質管理機構の観点から、発現タンパク質の構造が分泌に及ぼす影響について研究しています。本学会のポスター発表ではGRPの構造特性解析を中心に発表いたしました。聞きに来てくださった皆さまのおかげで活発に議論でき、また沢山アドバイスをいただくこともできて、とても有難く感じております。
蛋白質科学会への参加は初めてだったのですが、広く深く蛋白質科学を学ぶ機会となり、非常に充実した3日間になりました。今回の経験を励みにして、今後も日々怠らず研究に精進して参りたいと思っております。
最後に、日々ご指導していただいている相沢智康先生、新井達也先生、研究を支えてくださる蛋白質科学研究室のメンバーをはじめとした関係者の皆さまに、この場をお借りして心より感謝申し上げます。
2P-125 山下 舞佳(慶應義塾大学)

この度は、第24回日本蛋白質科学会におきましてポスター賞をいただき、大変光栄に存じます。
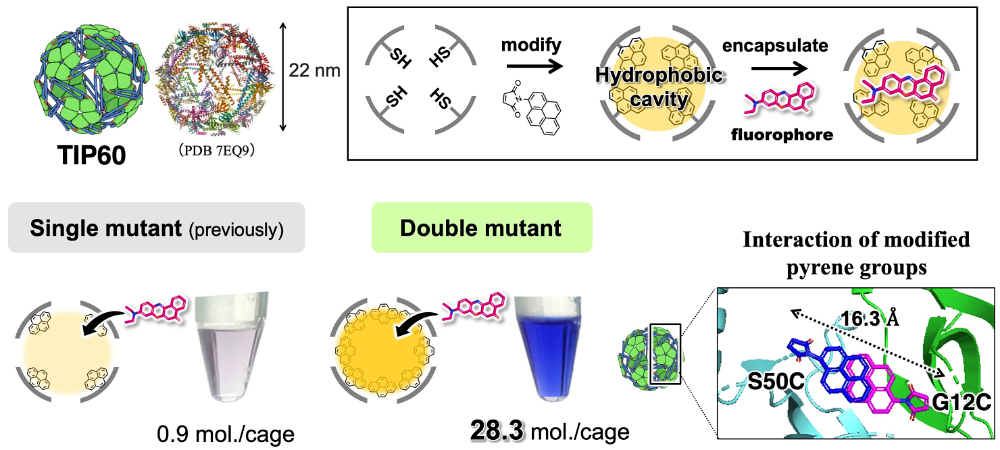
私はこれまで、疎水性分子の水中キャリアを開発する目的で、所属グループが設計・開発した人工ケージタンパク質TIP60について、内部を疎水化することを検討してきました。具体的には、多環芳香族分子であるピレンをケージの内側表面に化学修飾したところ、疎水性蛍光分子がケージ内に誘引され、水中で分散するようになることを認めました。TIP60分子の表面には、分子が通り抜けられる多数の広い孔があることから、このような設計が実現しています。
今回のポスター発表では、分子の内包効率を向上させる目的で、内部表面の修飾部位が2倍になるよう設計した二重変異体TIP60について報告いたしました。驚くべきことに、この変異体は、先行研究で用いた単変異体と比較して、30倍もの数の蛍光分子(ナイルレッド、NR)を内包することができました。この機構推定のため、立体構造上で推定される修飾部位にピレンを配置してみると、これらは相互作用しうる位置関係にありました。ここから、相互作用したピレンが強力な疎水ポケットを形成し、NRをトラップしたと推測しました。さらに、修飾ピレンの相互作用が、ケージ全体の熱安定性を20℃近く向上させることも認められました。
今後は、分子内包および熱耐性向上のメカニズムを明らかにするため、構造解析にも取り組む予定です。本研究が、タンパク質分子設計に関する新たな知見となることを信じて、これからも研究に邁進してまいります。
最後に、日々指導していただいております川上了史先生、SAXS測定の機会をくださった新井亮一先生、研究室の仲間達に、この場をお借りして心より感謝申し上げます。
2P-144 冨田 尚希(名古屋大学)

この度は第24回蛋白質科学会年会におきましてポスター賞をいただき、大変光栄に存じます。
私たちの研究は、天然タンパク質に多く見られるβαβモチーフという部分構造が右巻きのものばかりである理由を解明することを目的としています。この研究ではRosettaというソフトウェアを用いたシミュレーションを通じ、どのような二次構造とループの長さが右巻きβαβモチーフや左巻きβαβモチーフの形成に適しているかを調べました。その結果、
- 右巻きβαβモチーフと比べて左巻きβαβモチーフは、βシートとαヘリックスの間隔が狭くなる傾向にあるため、二次構造間の原始衝突を回避しながらβαβモチーフの形成をすることが難しい
- ある特定の二面角の組み合わせからなるループ構造の活用によって、二次構造どうしの間隔を広く保ちながら左巻きβαβモチーフを実現することができる
ということが明らかになりました。
さらに上記を踏まえ、実際に左巻きβαβモチーフを有するタンパク質を人工的にデザインしたところ、実験で解かれた構造が目標とする構造を形成していたことが確認され、私たちが研究で得た知見の妥当性が示されました。
ポスター発表では、このようにして明らかとなった、左巻きβαβモチーフが自然界に少ない理由や、左巻きβαβモチーフのデザイン手法について報告し、多くの方々と活発な議論ができたことを大変嬉しく思います。
今後は本研究で得られた知見を活用することで、これまで人工的なデザインが叶わなかった多くの左巻きβαβモチーフを含む構造を新たに生み出し、実現可能なタンパク質構造、またそれらと対応した機能のバリエーションを広げていきたいと考えています。
最後にこの場をお借りして、日頃からご指導いただいております指導教官の千見寺浄慈助教及びChavas研究室の皆様、また学会運営にご尽力いただいた関係者の皆様に厚く御礼申し上げます。
